辐射对人体来说是把双刃剑。凭借着能够使细胞中的DNA受损的能力,辐射既能使正常细胞癌变让人患上癌症,同时又能通过杀死癌细胞来治愈癌症。辐射影响DNA的途径之一,是在细胞中产生一系列活性物质与DNA发生反应。近日,上海纽约大学化学助理教授William Glover团队发表了一项新研究,探析其中一种活性物质——“水合电子”的特性,这一研究或将促进放射疗法相关领域的探索。该成果于今年秋季发表于化学领域顶尖期刊《美国化学会志》(Journal of the American Chemical Society, IF=16.4)。

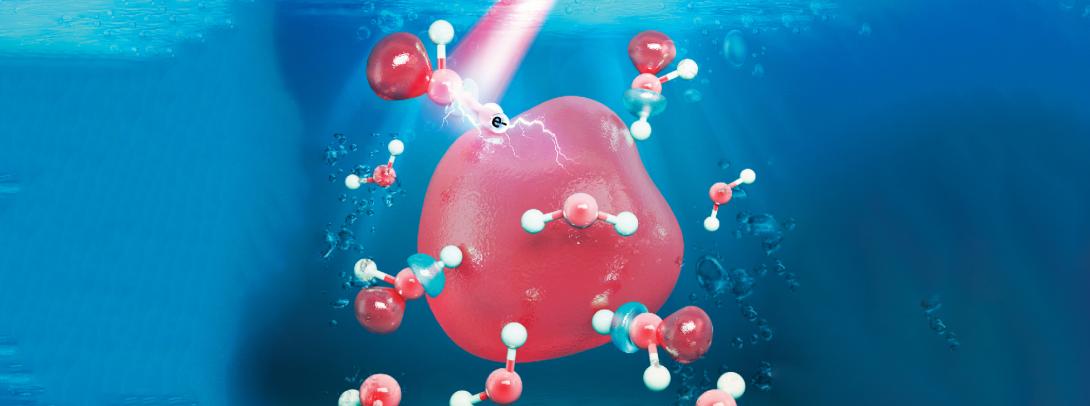
水合电子模拟图像(供图:William Glover课题组)
“水合电子是漂浮在液态水中的单个未成对电子。正因它们不附着于任何原子,所以具有很高的反应活性。我们的研究初衷是探究水合电子的性质,以使我们最终能理解水合电子是如何对DNA造成损伤的。”Glover教授说。
以往的理论模型通常假设水合电子仅占据由周围的水分子所形成的气泡状空腔。但Glover教授的团队通过对比模拟结果和实验观测证实:水合电子实际上会从腔体中溢出,并对周围的水分子产生影响。“我们的研究表明,水合电子有约30%的概率占据周围水分子的‘反键轨道’。具备这一性质的电子能够削弱分子内的化学键,这也许暗含了水合电子破坏DNA分子的方式。当分子内的化学键被严重削弱时,化学键会因此断裂并导致该分子(如DNA)受损。”Glover教授说。
该团队使用了X射线作为工具来探究水合电子的性质。“可以把整个实验想象成给水合电子四周的水分子做了一个‘X光检查’。我们发现,与普通的水分子不同,最贴近水合电子的几个水分子展现出了特殊的X射线吸收方式。为了更好地说明这一点,我们首先使用我们的理论模型对水合电子进行仿真模拟,并单独计算体系中每个水分子是如何吸收不同波长的X射线的。随后,将计算结果与其他团队的实验结果比较。两组数据相互吻合。水合电子四周的水分子对X射线的特殊吸收方式,是表明这些水合电子占据了周围水分子的‘反键轨道’的一个强有力的证据。”Glover教授说。
团队还采用了一种全新的分块化方法来计算水合电子对X射线的吸收光谱。论文第一作者李星频帮助设计了该计算方法。“简单来说,我们将研究中出现的复杂系统‘切’成小块,分别对每一个小块单独进行计算,再将拆解的计算结果加合,最后得到了与原有大体系精度相同的结果。”李星频说。该方法能够大幅提升整体的计算速度,与传统的计算方法相比,要快上数百倍。
目前,李星频正在准备今年12月的博士论文答辩,他也即将成为上纽大化学博士项目的首届毕业生。展望未来的职业规划时,李星频表示:“毕业后我或许不会继续留在学术界深耕,但仍想从事与化学有关的研究。此外,我对科普事业十分有热情,也想把这份兴趣与自己的职业发展有机地结合。”
该团队希望这项研究能够在未来对放射疗法的研究做出贡献。“整个放疗过程中的第一步就是使用足量的辐射来破坏癌细胞的DNA使之凋亡,而了解水合电子的特殊性质就是我们解答DNA受损过程是如何发生的这一问题的关键,”Glover教授说, “辐射是如何破坏生物分子的?从微观分子层面给出这个问题的答案对我们来说至关重要。从这一层面获得的知识将有助于我们优化对癌症患者的放疗方案,或研发出药效更好的药物来提升放疗的效果。”